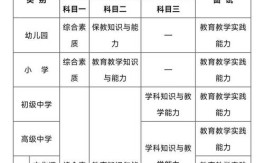
考试结构与核心模块
高中化学教师资格证考试分为两个主要部分:

- 《综合素质》(中学):主要考察职业理念、教育法律法规、教师职业道德、文化素养和基本能力,这部分对所有学科通用,但要注意结合化学教师的身份进行案例分析。
- 《教育知识与能力》(中学):这是核心部分,主要考察教育基础知识和基本原理、中学课程、教学、德育、班级管理、教师专业发展等,同样,案例分析题需要体现化学学科的特点。
- 《高中化学学科知识与教学能力》:这是化学学科的重中之重,主要考察以下三大模块:
- 学科知识:化学基本概念、基本理论、元素化合物知识、有机化学基础、实验化学等,要求达到大学化学专业水平。
- 教学知识:化学课程与教学论、教学设计、教学实施、教学评价等。
- 教学能力:结合学科知识进行教学设计、案例分析、教学评价等。
《高中化学学科知识与教学能力》高频考点与真题示例
以下是该科目中不同题型的典型考点和真题示例,帮助您理解出题思路。
学科知识(单选、填空、简答)
这部分考察的是你的化学专业功底,难度接近高考或大学期末水平。
高频考点 1:化学基本概念与理论
- 考点:物质的量、阿伏加德罗常数、氧化还原反应、离子反应、化学平衡、电离平衡、电化学等。
- 真题示例(单选题):
下列关于阿伏加德罗常数的说法,正确的是( ) A. 1 mol Na₂O₂与足量CO₂反应,转移的电子数为2NA B. 1 L 0.1 mol/L的CH₃COOH溶液中,CH₃COOH和CH₃COO⁻的总数为0.2NA C. 标准状况下,22.4 L Cl₂与足量Fe粉反应,转移的电子数为3NA D. 1 mol/L的NaCl溶液中,Na⁺的浓度为1 mol/L
 (图片来源网络,侵删)
(图片来源网络,侵删)答案:D 解析:A项,Na₂O₂与CO₂反应:2Na₂O₂ + 2CO₂ → 2Na₂CO₃ + O₂,化合价变化是O从-1价到0价,1 mol Na₂O₂中只有1 mol O化合价变化,所以1 mol Na₂O₂转移1 mol电子,A错误,B项,CH₃COOH是弱电解质,在溶液中部分电离,CH₃COOH和CH₃COO⁻的总数小于0.1NA,B错误,C项,Cl₂与Fe反应,Cl₂的量不足时生成FeCl₂,转移2 mol电子;Cl₂过量时生成FeCl₃,转移3 mol电子,题目未说明Fe的量,C错误,D项,浓度与溶液体积无关,D正确。
高频考点 2:元素化合物与有机化学
- 考点:典型元素(Na、Mg、Al、Fe、Cu、Cl、S、N等)及其化合物的性质、转化和制备;同分异构体、官能团性质、有机反应类型(取代、加成、消去、聚合等)。
- 真题示例(简答题):
请设计一个实验方案,证明某无色溶液中可能存在的离子有SO₄²⁻、CO₃²⁻、Cl⁻,简述实验步骤、现象和结论。
答案: 实验步骤、现象与结论:
 (图片来源网络,侵删)
(图片来源网络,侵删)- 取样:取少量待测溶液于试管中。
- 检验CO₃²⁻:向溶液中滴加足量稀盐酸,若产生无色无味的气体,该气体能使澄清石灰水变浑浊,则证明溶液中含有CO₃²⁻。(注意:此步骤会引入Cl⁻,影响后续检验,所以检验SO₄²⁻必须在检验CO₃²⁻之前或之后通过其他方式排除干扰)。
- 检验SO₄²⁻:另取少量待测溶液,先滴加足量稀盐酸酸化(排除CO₃²⁻的干扰),再滴加BaCl₂溶液,若产生白色沉淀,则证明溶液中含有SO₄²⁻。
- 检验Cl⁻:另取少量待测溶液,先滴足量AgNO₃溶液,产生白色沉淀,再滴加足量稀硝酸,若沉淀不溶解,则证明溶液中含有Cl⁻。(注意:若第2步已进行,此步会受干扰,因此更严谨的方案是先检验SO₄²⁻,再检验CO₃²⁻,最后检验Cl⁻,或用其他方法排除干扰)。
教学知识与能力(材料分析、教学设计)
这部分是考试的难点和重点,需要将化学学科知识与教育学、心理学理论相结合。
高频考点 1:教学设计
- 考点:根据给定的课题(如“物质的量”、“元素周期律”、“乙烯的制备”等),设计一份完整的教学方案,通常包括教学目标、教学重难点、教学方法、教学过程、板书设计、教学反思等。
- 真题示例(教学设计题):
课题:人教版高中化学必修二《元素周期律》 要求:
- 写出本节课的三维教学目标。
- 确定本节课的教学重难点。
- 设计一个包含导入、新课讲授、巩固小结的教学过程。
答案(要点): 三维教学目标
- 知识与技能:
- 能说出元素周期律的内容(原子核外电子排布、原子半径、主要化合价、金属性/非金属性的周期性变化)。
- 初步学会运用元素周期律解释一些简单的化学现象。
- 过程与方法:
- 通过分析数据图表,归纳出元素周期性变化规律,培养数据分析能力和归纳总结能力。
- 通过小组讨论,合作探究,培养团队协作和表达能力。
- 情感态度与价值观:
- 通过元素周期律的发现史,感受科学家的探究精神和严谨求实的科学态度。
- 认识到事物变化中量变引起质变的规律,树立辩证唯物主义世界观。
教学重难点
- 教学重点:元素周期律的内容(原子半径、化合价、金属性/非金属性的周期性变化)。
- 教学难点:元素性质周期性变化的原因(原子核外电子排布的周期性变化);对“位-构-性”关系的初步理解。
教学过程(简述)
- 导入(约5分钟):
- 情境创设:展示门捷列夫的元素周期表图片,讲述他“玩扑克牌”排列元素并预言新元素的故事,激发学生兴趣。
- 提出问题:元素的性质是不是也像它们的排列一样,存在着某种规律呢?从而引出本节课课题。
- 新课讲授(约25分钟):
- 探究原子核外电子排布的周期性变化
- 展示1-18号元素的原子结构示意图,引导学生分组讨论,从电子层数和最外层电子数两个角度寻找规律。
- 师生共同总结:随着原子序数的递增,元素原子的最外层电子数呈现周期性变化(1→8)。
- 探究原子半径和化合价的周期性变化
- 提供数据表,让学生找出原子半径和主要化合价随原子序数递增的变化规律。
- 学生汇报,教师总结:原子半径和主要化合价也呈现周期性变化。
- 探究金属性和非金属性的周期性变化
- 以第三周期为例,通过实验视频或演示实验(如Na、Mg、Al与水的反应,Si、P、S、Cl₂与H₂的反应)比较元素金属性和非金强弱的递变规律。
- 引导学生得出结论:元素的金属性和非金属性也呈现周期性变化。
- 归纳总结:师生共同总结元素周期律的定义和内容。
- 巩固小结(约10分钟):
- 课堂练习:给出几组元素,让学生判断其原子半径、金属性、最高正化合价的相对大小。
- 课堂小结:请学生用自己的话复述本节课学到的核心规律,教师进行补充和升华,初步点出“位-构-性”的关系。
- 布置作业:完成课后习题;预习下一节《元素周期表》。
高频考点 2:材料分析题
- 考点:给出一段教学案例、课堂实录或学生访谈材料,要求运用教育学、心理学或化学课程与教学论的知识进行分析和评价。
- 真题示例(材料分析题):
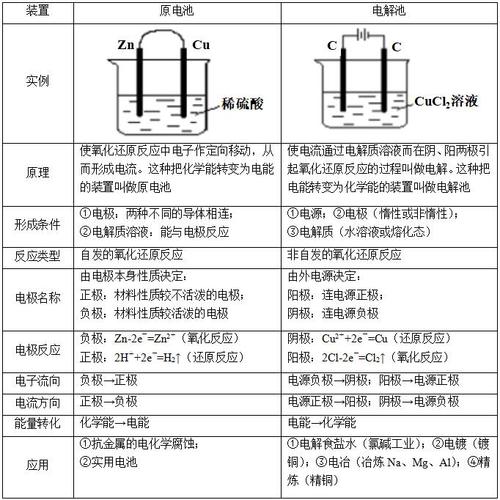
材料:某老师在讲授“原电池”一节时,首先演示了“铜锌原电池”实验,观察到电流表指针偏转,老师提问:“为什么这个装置能产生电流?电流是如何产生的?” 老师引导学生从电子转移的角度进行分析,并给出了原电池的构成条件,老师让学生分组讨论:“如果给你铜片、锌片、稀硫酸、导线、电流表,你还能设计出哪些能产生电流的装置?”
问题:请结合新课程改革的理念,评价该老师的教学行为。
答案(要点): 该老师的教学行为体现了新课程改革的诸多先进理念,值得肯定。
注重科学探究,落实“做中学”。 老师没有直接灌输原电池的定义和原理,而是通过演示实验创设问题情境,引导学生观察、思考和分析,将知识的获取过程转变为学生的探究过程,这体现了“以学生为主体”的教学思想。
体现STS(科学-技术-社会)教育思想。 原电池的知识与生活实际(如各种电池)紧密相关,老师引导学生设计新的原电池,是将理论知识应用于实践的过程,有助于培养学生的创新能力和解决实际问题的能力,认识到化学的实用价值。
培养学生的核心素养。 在整个过程中,学生不仅掌握了“证据推理与模型认知”(通过实验现象推理电子转移,建立原电池模型),也锻炼了“科学探究与创新意识”(分组讨论设计方案),还培养了“科学态度与社会责任”(认识化学能源的重要性)。
教学方法多样化。 综合运用了实验演示、问题引导、小组讨论等多种教学方法,激发了学生的学习兴趣和主动性,课堂气氛活跃。
建议:如果时间允许,可以让学生亲自动手操作实验,体验从失败到成功的探究过程,这样学生的感受会更深刻,对知识的理解也会更牢固。
备考策略
- 回归教材,夯实基础:高中化学的《必修1》、《必修2》、《选修3(物质结构与性质)》、《选修5(有机化学基础)》是根本,大学的知识是拔高,但所有考点都源于高中教材,把教材吃透,是应对学科知识部分的最佳策略。
- 真题演练,把握方向:找近5-10年的真题进行练习,重点不是记住答案,而是分析考点分布、题型特点、答题思路和评分标准,特别是教学设计和案例分析题,要多看标准答案,学习其专业术语和答题逻辑。
- 理论联系实际,关注教学:在复习学科知识时,要时常思考:“这个知识点我该怎么教给学生?”、“学生会在这里遇到什么困难?”、“可以用什么实验或生活实例来引入?” 这种“双重身份”的思考方式,是准备教学能力模块的关键。
- 关注教育热点:了解最新的化学课程改革动态,如“核心素养”、“大单元教学”、“项目式学习(PBL)”等,这些概念很容易出现在材料分析题中,体现你的教育理论素养。
- 动手写,动手设计:教学设计题不能只看不练,一定要亲手写几份完整的教学设计,从教学目标的撰写到教学过程的每一个环节,都要进行刻意练习,可以找有经验的老师或同学进行批改和点评。
祝您备考顺利,成功上岸!